2021, año récord de aprobaciones de medicamentos de los últimos 5 años
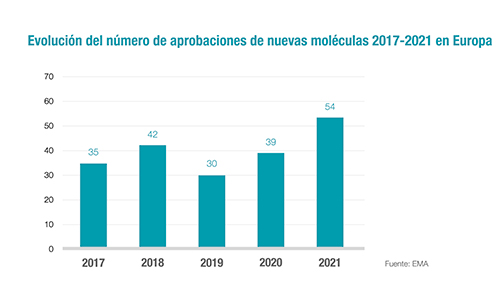
En su comunicado más reciente Farmaindustria hace referencia al último informe anual sobre aprobaciones de tratamientos de la Agencia Europea de Medicamentos (EMA).
En este sentido, 2021 registró el récord de nuevas moléculas autorizadas en los últimos 5 años en la región, con 54 principios activos, y sólo en este lustro la EMA ha dado luz verde a 200 sustancias completamente nuevas.
Oncología (con 12), vacunas y tratamientos contra la Covid-19 (7) y hematología y neurología (5) fueron las áreas terapéuticas con más aprobaciones el año pasado. Aunque también otros campos se han visto beneficiados y han aumentado su arsenal terapéutico.
Entre las 54 novedades sobresalen dos nuevos productos considerados terapias avanzadas. Asimismo, el informe de la EMA indica que se aprobaron 89 nuevas indicaciones para medicamentos ya autorizados, incluidas 35 para uso pediátrico.
Tiene especial relevancia que 19 de las 54 novedades terapéuticas (un 35%) hayan sido categorizadas como medicamentos huérfanos, lo que ratifica el impulso de la investigación por parte de la industria farmacéutica innovadora en al área de las enfermedades raras o poco frecuentes
La EMA achaca esta evolución positiva al programa Prime que fue puesta en marcha en 2016 ha acelerado la autorización de nuevos medicamentos, dando a los pacientes un acceso más temprano a tratamientos transformadores que pueden marcar una diferencia real en su salud.
Por otra parte, El informe de la agencia reguladora estadounidense (FDA) arroja cifras similares de aprobaciones a las de la EMA. El Centro de Evaluación e Investigación del Medicamento de la citada FDA (CDER,) aprobó 50 nuevos tratamientos en 2021, una cifra ligeramente inferior a la de la EMA, lo que ocurre por primera vez en los últimos años.
Entre las novedades, el CDER identifica 27 fármacos (un 54%) como primeros de su clase (first-in-class), es decir, medicamentos que tienen mecanismos de acción diferentes a los de las terapias existentes o que tratan necesidades médicas no cubiertas. Y también que una de cada dos innovaciones es considerada como medicamento huérfano.
Y ADEMÁS



EMPRESAS PREMIUM


Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO