La gestión efectiva del conocimiento es esencial en el sector farmacéutico, en el que se requiere obligatoriamente un entendimiento y control profundos de la calidad del producto.
El mapeo detallado de un proceso es un punto de partida óptimo para evaluar, compartir y mejorar el conocimiento disponible. Un mapa detalla las funciones individuales y todos los elementos relacionados, involucrados en un proceso, como los materiales entrantes y los pasos intermedios del proceso que se convertirán en el resultado final, las condiciones del proceso que hay que respetar en cada fase y el equipamiento necesario para la correcta ejecución de los pasos.
El mapeo detallado y completo puede además aportar una base sólida para la Análisis del riesgo y la evaluación de la criticidad.
Muchos pensarán primero en el mapeo de un proceso de producción clásico para un producto medicinal. Sin embargo, es importante recordar que se pueden mapear no sólo los procesos de producción, sino también flujos transaccionales, diseño del producto y, ¿por qué no?, el diseño de nuevo equipamiento de producción.
El desarrollo de un nuevo producto en Quality by Design (QbD) permite estudiar, identificar y formalizar las correlaciones entre el producto para su producción (junto a su nivel de calidad) y las características del proceso para su diseño.
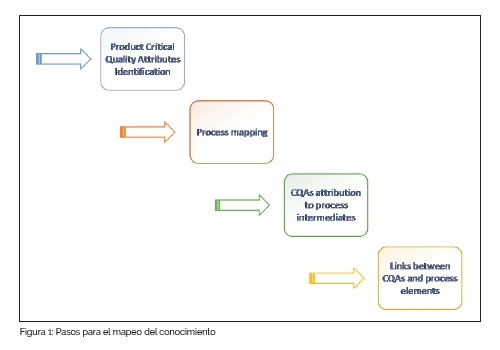
Se necesita un enfoque metodológico para conseguir un resumen del conocimiento disponible sobre el proceso considerado, incluidas sus correlaciones entre calidad del producto y condiciones de producción. Para llevarlo a cabo, es necesario seguir algunos pasos.
En primer lugar, la identificación de los atributos críticos de calidad (Critical Quality Attributes - CQAs) del producto permite estudiar todo el sistema, garantizando que se tomen en consideración todos los elementos relevantes. Una lista completa de estos atributos reduce el riesgo de omitir características importantes. Los CQAs del producto final son la descripción cali-cuantitativa del resultado final del mapeo de proceso y, retrocediendo a lo largo del proceso, se pueden enumerar para cada paso intermedio.
Para perfeccionar el proceso de mapeo, es esencial recordar que sirve como base para los siguientes pasos del proyecto. Por lo tanto, es esencial detallar todas las características del producto relacionadas con calidad y seguridad.
.jpg)
En segundo lugar, es importante también una descripción detallada del flujo del proceso de producción para identificar todos los pasos clave (funciones básicas) que contribuyen a la producción. Cada paso se puede desglosar en subpasos para proporcionar una representación completa del proceso, garantizando la inclusión de las actividades estándar, que de otra manera se podrían pasar por alto.
Dada la complejidad de la producción farmacéutica, es importante establecer el nivel adecuado de detalle necesario para entender totalmente y gestionar el proceso de producción.
Una vez finalizada la lista de pasos del proceso, se debería describir cada paso demostrando:
- Las entradas y los resultados involucrados, que representan lo que entra para ser transformado y lo que se obtiene (descrito por completo a través de la lista de atributos),
- Los parámetros y las condiciones de producción del proceso que se tienen que establecer y gestionar para la correcta ejecución (mencionados como "Controls" en lenguaje IDEF0),
- El equipamiento y las herramientas necesarios para la correcta implementación del proceso de producción (mencionados como " Mechanisms " en lenguaje IDEF0).
Empezando por la descripción de calidad del producto final, se debería describir cada paso intermedio del proceso hasta la definición de los atributos críticos del material entrante. Esta actividad fundamental permite identificar los paso específicos del proceso en los que se generan los atributos de calidad.
Es importante recalcar que cada elemento del mapeo, no sólo la Entrada y el Resultado, sino también los Mechanisms y Controls, se tienen que describir a través de descripciones cali-cuantitativas llamadas “parámetros” para la correcta producción del producto.
.jpg)
En tercer lugar, se debería desarrollar un uso compartido y formalización del conocimiento completo, a través de la descripción de las correlaciones entre atributos y características del proceso. Se sabe bien que varios aspectos del proceso de producción tienen efecto sobre la calidad del producto y cada uno se tiene que vigilar atentamente para garantizar la robustez del proceso y mantener una alta calidad.
El mapeo de proceso puede servir como depósito para esta información, permitiendo la recopilación de correlaciones entre atributos de calidad del producto y parámetros, equipamiento y herramientas del proceso. Se debe prestar especial atención en los parámetros del proceso, tomando en consideración lo que se reporta en ICHQ8 sobre el Desarrollo de proceso: "parameter whose variability impacts a critical quality attribute should be monitored or controlled to ensure the process produces the desired quality." Así, los parámetros del proceso que tienen efecto sobre los CQAs se deberían identificar como "Parámetros críticos de proceso" (Critical Process Parameters - CPPs).
Este paso importante y a menudo pasado por alto es fundamental para identificar las características que se tienen que estudiar, fijadas en condiciones óptimas, y controlar para garantizar la calidad del producto.
Una vez finalizado el mapeo de proceso, se pueden empezar las actividades de evaluación del riesgo, con el fin de identificar las potenciales áreas de riesgo. Una evaluación del riesgo efectiva tiene que estar alineada con los objetivos de la evaluación. En los casos en los que el proceso está sólidamente establecido y se han producido en el tiempo lotes comerciales, podría ser viable aprovechar la información obtenida de las desviaciones, elementos fuera de especificación o quejas para evaluar con exactitud la probabilidad de producir con una calidad insuficiente. Por el contrario, si el proceso no se entiende completamente, la evaluación del riesgo puede ayudar a identificar las áreas de incertidumbre del conocimiento, lo que indica la necesidad de más investigación. Un enfoque sistemático para la evaluación de los detalles del proceso, como el análisis del riesgo, conduce no sólo a la identificación de áreas no del todo conocidas, sino que ayuda también a priorizar las investigaciones, empezando por las que están relacionadas con potenciales efectos graves.
A menudo se pasa por alto la posibilidad de estudiar aspectos del proceso no totalmente conocidos a través de actividades experimentales dedicadas, ya que se percibe como un mal uso de tiempo valioso. Se debe desafiar enérgicamente la tendencia a conformarse sólo con la información necesaria a producir lotes de validación, descuidando los esfuerzos para comprender totalmente el proceso y el producto. Dada su complejidad e importancia, no se debería tolerar la falta de conocimiento en los productos farmacéuticos.
Una vez anotados y priorizados los pasos del proceso (o parámetros/equipamiento específicos) a través de una detallada evaluación del riesgo, se debería programar un enfoque sistemático para las pruebas experimentales, para centrar el esfuerzo en un panel de estudios que garantice la recopilación de información insuficiente. Según lo que se ha explicado anteriormente, un adecuado mapeo de proceso parece ser un soporte inestimable, ya que:
- Los atributos de calidad de salida identifican claramente los factores de respuesta experimentales que evitan cualquier ambigüedad,
- Una descripción detallada de pasos principales y subpasos permite considerar también funciones “anidadas” y el impacto relacionado,
- El conocimiento anterior se formaliza a través de vínculos entre atributos de calidad y elementos del proceso que recalcan los parámetros que tienen que convertirse en variables experimentales de los estudios,
- La formalización de los vínculos proporciona un resumen completo de todos los impactos potenciales, tanto principales como secundarios, que se tienen que tomar en consideración durante la definición de las pruebas experimentales y la evaluación de los resultados.
El mapeo completo del proceso proporciona, entonces, una formalización ordenada de la información disponible y, al mismo tiempo, de las que se tienen que investigar.
El Design of Experiments (DoE) es uno de los enfoques más adecuados para la planificación de las pruebas experimentales. Ya que permite incluir varios parámetros en el mismo plano, contribuye a comprender totalmente diferentes aspectos al mismo tiempo. En comparación con un enfoque experimental estándar (como el método “Change One Setting at a Time”) lleva a la adquisición de informaciones más completas sobre los pasos del proceso considerados. No permite sólo la estimación del impacto que un único parámetro puede tener sobre la calidad del producto, sino que identifica también un mayor nivel de complejidad, demostrando la interacción que varios parámetros pueden tener al mismo tiempo en la calidad del producto. Hay que reconocer que el DoE no reduce el esfuerzo necesario para la investigación experimental, pero con un esfuerzo comparable se obtiene mucha más información. El Diseño de Experimentos es sin duda uno de los enfoques estadísticos más populares en los estudios de desarrollo, pero no es el único. Según las necesidades y límites y restricciones del proceso, se pueden tomar en consideración diferentes herramientas estadísticas durante la definición del plan experimental.
Una continua evaluación del conocimiento adquirido sobre el proceso de producción durante el desarrollo puede ayudar a identificar las características del proceso que, como se demuestra en los estudios, no afecta la calidad del producto final. Por otro lado, la evaluación estructurada del riesgo lleva a la identificación de los parámetros del proceso (Critical Process Parameters) y las características del equipamiento que tienen un claro impacto en la calidad del producto final. Estos, por diseño, se deben establecer adecuadamente y más actividades de validación del proceso demostrarán la fiabilidad del proceso de producción definido, con sus parámetros y características del equipamiento controlados.
El enfoque metodológico aquí descrito, en el que el conocimento se recopila y formaliza continuamente, llevando a una sólida comprensión y a un desarrollo del proceso, al final proporcionará un camino sólido para más actividades de validación basadas en el riesgo.
La validación basada en el riesgo es, sin duda, la demostración de la robustez y fiabilidad del proceso de producción, a través del desafío hacia los parámetros vinculados a riesgos potencialmente inaceptables, en función del conocimiento recopilado. La evaluación continua del riesgo del proceso integrada en el desarrollo del mismo proporcionará una confianza sólida sobre los riesgos concretos de la producción comercial.
Descarga sugerida:
Artículo escrito por:
Silvia Piersanti
,PTM Consulting


.jpg)
.jpg)