La industria farmacéutica está en plena transformación para la adopción exitosa de las diferentes tecnologías de la Pharma 4.0, un concepto basado en la integración de tecnologías avanzadas como la digitalización, la automatización y la inteligencia artificial en todos los aspectos del desarrollo, producción, y distribución de medicamentos. Inspirado por los avances de la Industria 4.0, Pharma 4.0 tiene como principal objetivo optimizar la eficiencia operativa, mejorar la calidad de los productos y acelerar la innovación, lo que permite la creación de nuevos tratamientos y medicamentos de forma más rápida en beneficio de los pacientes.
En esta andadura de transformación digital, las organizaciones deben integrar estas tecnologías sin comprometer la calidad de los productos, ni los rigurosos estándares regulatorios de la industria farmacéutica y afín. Este cambio tecnológico requiere que las empresas no solo adopten las nuevas tecnologías, sino que también las integren de manera efectiva y progresiva en los sistemas de calidad existentes, sin comprometer la calidad ni el cumplimiento regulador.
Gestión de Datos
Una de las piedras angulares de la Industria 4.0 es la gestión inteligente de los datos. La industria farmacéutica genera enormes volúmenes de información a lo largo del ciclo de vida de un medicamento, desde los ensayos clínicos hasta la producción y distribución. Sin embargo, el verdadero valor de esta información solo se alcanza cuando se convierte en datos útiles para la toma de decisiones efectivas.
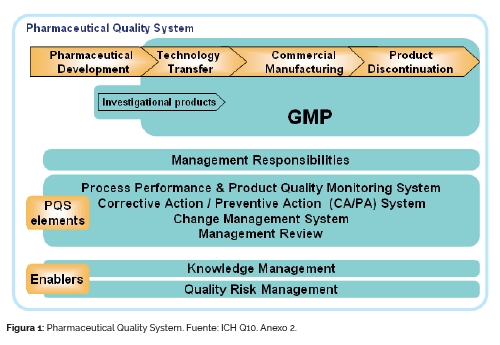
El sistema de calidad farmacéutico (PQS), tal como lo establece la ICH Q10, debe integrar la gestión de riesgos de calidad (QRM) y la gestión del conocimiento (KM) para anticipar y resolver posibles problemas en la cadena de suministro, tanto internos como externos (Figura 1). Esto contribuye a mejorar la fabricación, optimizar las estrategias de control y validar los procesos con un enfoque más científico, lo que reduce defectos, retiradas de productos y costes. Además, se debe adoptar un enfoque holístico, promoviendo la colaboración interdisciplinaria entre los distintos departamentos, así como entre las organizaciones externas implicadas en el ciclo de vida del producto.
Este proceso de generación de conocimiento a partir de los datos sigue la estructura de la pirámide DIKW (Datos, Información, Conocimiento, Sabiduría), que se puede resumir de la siguiente forma (Figura 2):
- Datos: Son hechos sin procesar, como lecturas de sensores o registros clínicos.
- Información: Surge cuando los datos se organizan y contextualizan permitiendo comprender patrones o tendencias.
- Conocimiento: Se obtiene al interpretar la información y usarla para tomar decisiones.
.jpg)
Así pues, los datos se recogen y analizan para la toma de decisiones, la información ayuda a comprender el pasado y prever el futuro, mientras que el conocimiento (que incluye el capital humano y estructural) se gestiona para generar valor y competitividad.
Nuevas Tecnologías
La Industria 4.0 se apoya en una serie de tecnologías avanzadas. A continuación, se detallan las tecnologías más relevantes para la industria farmacéutica:
- Inteligencia Artificial (AI) y Aprendizaje Automático (ML):
Estas tecnologías permiten:
- Identificar nuevas moléculas con potencial terapéutico.
- Optimizar la formulación de medicamentos.
- Prever fallos en equipos de producción para un mantenimiento predictivo.
- Personalizar tratamientos según los datos genéticos de pacientes mejorando su eficacia.
- Internet de las Cosas (IoT) y Sensores Inteligentes:
El IoT conecta los diferentes equipos y sistemas. Estos sensores inteligentes permiten monitorizar:
- Las condiciones ambientales en plantas de producción.
- Los parámetros de calidad en tiempo real.
- El estado de los equipos para la mejora de su mantenimiento.
- Computación en la Nube y Big Data:
La computación en la nube ofrece almacenamiento y procesamiento seguro y eficiente de grandes volúmenes de datos que combinado con Big Data permite:
- Agilizar la investigación de nuevos medicamentos.
- Identificar patrones y tendencias en los datos de salud pública.
- Mejorar la trazabilidad y la gestión de la cadena de suministro.
- Fabricación Inteligente, Automatización y Realidad aumentada:
La automatización de la producción reduce los errores humanos y garantiza la calidad mediante el uso de:
- Robots en plantas de producción.
- Gemelos digitales que simulan los procesos productivos en tiempo real.
- Realidad aumentada en formación, y asistencia en mantenimiento.
- Realidad virtual en experimentación/diseño y mejora de procesos productivos.
- Impresión 3D para la fabricación de medicamentos personalizados.
- Blockchain para la Trazabilidad de Medicamentos:
Por sus características intrínsecas de transparencia, e integridad de los datos, se prevé que esta tecnología desempeñe un papel relevante en la lucha contra la falsificación de medicamentos, así como dentro de la logística y la distribución.
Marco de gestión estratégico
Para que las tecnologías emergentes sean adoptadas correctamente, es necesario establecer un marco de gestión estratégico alineado con los principios de la Industria 4.0 / Pharma 4.0, así como con las buenas prácticas del sector para garantía de un proceso de transformación digital efectivo y conforme al marco regulador. Algunos de los aspectos clave de este marco de gestión incluyen:
- Comprensión de los principios fundamentales: Se debe adoptar una visión global (enfoque holístico) de los procesos a lo largo del ciclo de vida del producto, garantizando que todos los departamentos trabajen de manera interdisciplinaria.
- Enfoque basado en datos para la toma de decisiones: Las empresas deben implementar una gobernanza de datos sólida que asegure que los datos sean precisos y estén accesibles, lo que a su vez facilitará la optimización de los procesos y el cumplimiento normativo.
- Integración de tecnologías y procesos: La transformación digital debe integrarse de manera eficiente en todos los niveles operativos. Esto incluye desarrollar una hoja de ruta clara para la implementación de nuevas tecnologías y la utilización de metodologías ágiles que permitan adaptarse a los cambios de manera continua.
- Gestión del cambio organizacional: Es esencial que las empresas capaciten a su personal en las nuevas competencias digitales y fomenten una cultura organizacional orientada a la innovación y la adaptación al cambio.
- Cumplimiento normativo y seguridad: La seguridad del paciente y la integridad de los datos deben ser prioridades. La implementación de herramientas de gestión de riesgos y sistemas de ciberseguridad robustos han de garantizar la protección de los datos sensibles y el cumplimiento regulador.
- Evaluación, medición del progreso y optimización continua: Para asegurar el éxito de la implementación de nuevas tecnologías deben definirse KPI para medir el avance, así como evaluaciones de riesgos basados en los principios fundamentales. Es por ello, muy útil realizar una evaluación inicial de nuestro nivel de madurez digital para conocimiento del estado actual de nuestra organización.
Guías ISPE
La ISPE ha desarrollado diversas guías para apoyar la implementación de nuevas tecnologías dentro de un marco de calidad y cumplimiento, en donde destacan las siguientes guías:
- ISPE Baseline® Guide Pharma 4.0™: Proporciona un marco estructural para el logro de transformaciones digitales exitosas y sostenibles. Ofrece orientación en el modelo operativo Pharma 4.0 que establece cuatro elementos clave, “recursos humanos”, “cultura”, “organización y procesos”, y “sistemas de información” así como los facilitadores de "madurez digital" e "integridad de datos por diseño" para definir las capacidades necesarias para digitalizar la cadena de suministro de extremo a extremo. A destacar su herramienta de evaluación de madurez digital.
- ISPE GAMP® 5 Guide: Esta guía promueve la implementación de sistemas confiables y de alta calidad. A destacar su enfoque de pensamiento crítico y verificación (en línea con aproximación CSA).
- ISPE GAMP® RDI Good Practice Guide: Fomenta la aplicación del pensamiento crítico para evaluar y mitigar los riesgos relacionados con los datos durante el ciclo de vida de los sistemas. Enfatiza la integridad de los datos como parte fundamental para proteger la seguridad del paciente y la calidad del producto.
Beneficios y Desafíos
La digitalización en la industria farmacéutica ofrece beneficios clave como la mejora de la eficiencia operativa, la reducción de costes y una mejor calidad y seguridad de los productos mediante la monitorización en tiempo real. El uso de AI y modelos predictivos también acelera la innovación en la investigación y desarrollo. Además, la personalización de los tratamientos y la mejora en la sostenibilidad son otros beneficios clave.
Sin embargo, la transición hacia este modelo digital presenta varios desafíos. La integración de sistemas heredados es uno de los principales obstáculos, ya que muchas empresas aún dependen de tecnologías antiguas que no se integran fácilmente con los nuevos sistemas. Además, la interoperabilidad entre plataformas y la estricta regulación (EMA, FDA) representan desafíos adicionales. La ciberseguridad es también un riesgo creciente debido al aumento de los sistemas interconectados. Por último, la gestión del cambio organizacional es fundamental para garantizar que el personal esté preparado para adaptarse a las nuevas tecnologías.
Conclusión
Pharma 4.0 ofrece beneficios significativos en términos de eficiencia, calidad y seguridad. Sin embargo, el éxito de esta transformación depende de la capacidad de las empresas para gestionar de manera efectiva los datos, cumplir con las normativas y garantizar la seguridad digital. Las organizaciones que adopten un marco estructurado estarán mejor preparadas para liderar la innovación y mejorar la salud global.
Abreviaturas
- [1] PQS: Pharmaceutical Quality System.
- [2] QRM: Quality Risk Management.
- [3] KM: Knowledge Management.
- [4] DIKW: Data, Information, Knowledge, Wisdom.
- [5] AI: Artificial Intelligence.
- [6] ML: Machine Learning.
- [7] IoT: Internet of things.
- [8] 3D: Three dimensional.
- [9] KPI: Key performance indicator.
- [10] ISPE: International Society for Pharmaceutical Engineering.
- [11] CSA: Computer Software Assurance.
- [12] EMA: European Medicine Agency.
- [13] FDA: Food and drug administration.
Referencias
- [1] ICH Guideline Q10 Pharmaceutical Quality System. June 2008.
- [2] ICH Guideline Q9 (R1) Quality Risk Management. January 2023.
- [3] ISPE Baseline Guide Vol 8: Pharma 4.0 1st Edition. December 2023.
- [4] ISPE GAMP® 5 Guide 2nd Edition: A Risk-Based Ap- proach to Compliant GxP Computerized Systems. July 2022.
- [5] Computer Software Assurance for Production and Quality System Software. Draft Guidance for Industry and Food and Drug Administration Staff. September 2022.
- [6] ISPE GAMP® 5 RDI: Data integrity by Design. October 2020.
Descarga sugerida:
Artículo escrito por:
M. Díaz Miranda
Validation Technical Manager
,Trescal Life Sciences España


.jpg)