Los titulares de autorización de comercialización de medicamentos deben tener un sistema de farmacovigilancia y de calidad que les permita cumplir con sus responsabilidades legales, asegurando un monitoreo continuo de la seguridad de los medicamentos y la detección de cambios en la relación beneficio-riesgo de estos.
Los key performance indicators (KPI) o indicadores claves de desempeño son métricas usadas para medir el grado de cumplimiento de objetivos preestablecidos de un proceso. Junto con las auditorias e inspecciones son una herramienta fundamental para evaluar el funcionamiento del sistema de farmacovigilancia en relación con los requisitos de calidad y se encuentran detallados en el anexo F del archivo maestro del sistema de farmacovigilancia (PSMF, del inglés, Pharmacovigilance System Master File). También se pueden encontrar KPI en otros contextos, por ejempo en acuerdos de intercambio de datos de seguridad de medicamentos entre socios comerciales y proveedores de servicios (SDEA).
A la hora de definir los KPI que se van a utilizar se debe seguir el método SMART, es decir, estos deben ser específicos (en inglés specific), medibles, alcanzables, relevantes y consecuentes en el tiempo. En primer lugar, se deben identificar los procesos del sistema de farmacovigilancia que son críticos para el cumplimiento de los requerimientos regulatorios. Una vez identificados se debe describir de forma específica qué y cómo se va a medir, con qué frecuencia y qué resultado se espera alcanzar.
De manera periódica, el equipo de farmacovigilancia y garantía de calidad, recopila y analiza los datos para determinar si se alcanzaron los objetivos o es necesario realizar algún cambio en los procesos, en los KPI utilizados o tomar acciones correctivas o preventivas para asegurar o mejorar la calidad del sistema.
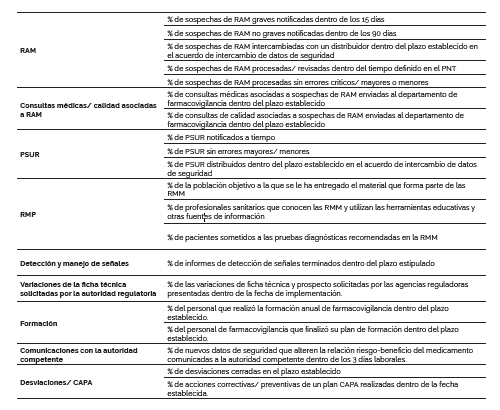
Los principales procesos de farmacovigilancia que se suelen monitorizar de manera rutinaria son, entre otros, las notificaciones de los casos de sospechas de reacciones adversas a medicamentos (RAM), la preparación y presentación de los informes periódicos de actualización de seguridad (PSUR), la detección de señales de seguridad, y el cumplimiento de las actividades de minimización de riesgo planteadas en el plan de manejo de riesgos (RMP) y de las formaciones.
La notificación de las sospechas de RAM es un proceso crítico que puede tener varios pasos y responsables según la complejidad de la compañía, no es lo mismo una empresa con pocos productos comercializados en España, que una con un porfolio amplio y distribuidores en varios países. Se pueden establecer KPI relacionados con los tiempos de notificación a las agencias regulatorias, con los tiempos internos de la compañía para la distribución o procesamiento del caso, o con la calidad de los datos.
En ocasiones las notificaciones de sospechas de RAM incluyen consultas médicas o relacionadas con defectos de calidad de los productos que se deben direccionar a otras áreas de la compañía en los plazos definidos en los procedimientos normalizados de trabajo (PNT). En este caso se podría medir el grado de cumplimiento del intercambio de información entre las áreas dentro de los plazos.
La preparación de los PSUR involucra diferentes pasos que deben de estar establecidos en los PNT, como dar aviso a los responsables de la redacción, recolectar información de diferentes departamentos (p.ej. comercial, regulatorio, calidad), redactar y revisar el documento, envío a las autoridades regulatorias en los tiempos establecidos y distribuirlo a los socios comerciales. En este caso también se pueden establecer KPI relacionado con los tiempos y la calidad del documento.
Dentro de los RMP con medidas de minimización de riesgo (RMM) adicionales se podría medir la distribución de los materiales adicionales a los profesionales sanitarios o el efecto de la aplicación de esas medidas en el control o prevención de algún riesgo en particular.
Otras actividades de farmacovigilancia en las que se establecen KPI son el cumplimiento de los plazos para la realización de las detecciones de señales, la implementación de las recomendaciones del Comité Europeo de Farmacovigilancia (PRAC) tras la evaluación de señales o las variaciones de la ficha técnica solicitadas por la autoridad sanitaria nacional.

Los KPI pueden también usarse para evaluar el cumplimento de las formaciones anuales de farmacovigilancia para todos los empleados de la compañía, así como el cumplimiento de los planes de formación del personal que realiza las actividades de farmacovigilancia.
Dentro de los procesos críticos de farmacovigilancia está la comunicación con las autoridades competentes, ya sea responder a sus solicitudes, así como la comunicación de cuestiones de seguridad que puedan modificar la relación riesgo-beneficio de los medicamentos.
Por otro lado, también se debería de monitorizar la resolución de desviaciones y acciones correctivas y preventivas (CAPA) relacionadas con actividades de farmacovigilancia, en los plazos establecidos.
En PVpharm trabajamos con numerosos KPI. Existen KPI globales para el departamento de farmacovigilancia y KPI específicos para cada uno de los proyectos en concreto. Al existir numerosos tipos de proyectos, existe una gran variabilidad. Se presentan a continuación algunos ejemplos de KPI que podrían formar parte de un sistema de farmacovigilancia.
En conclusión, los KPI aplicados a la farmacovigilancia son indicadores que nos permiten medir el cumplimiento de los objetivos del sistema de farmacovigilancia y actividades relacionadas realizadas por terceros. Su evaluación periódica permite determinar si se han alcanzado los objetivos o si es necesario realizar algún cambio en los procesos para asegurar o mejorar la calidad del sistema.
Descarga sugerida:
Artículo escrito por:
Maria Soledad Pelayo, Nuria Ponce Redondo, José Alberto Ayala Ortiz
Safety physician / PV officer, QA specialist PVpharm, PV consultant - respectivamente
,PVpharm